Caenorhabditis elegans ca model pentru înțelegerea rolului moștenirii epigenetice în microevoluție
În decursul ultimelor decenii, epigenetica s-a remarcat ca fiind un domeniu captivant al cercetării, întrucât explorează schimbările din tiparele moștenite care nu depind de modificări ale ADN-ului, ci sunt strâns legate de interacțiunile dintre organism și mediu. Marcajele epigenetice sunt modificări chimice care au loc în cromozomi și care au ca rezultat inhibarea sau activarea unor gene specifice în diferite țesuturi. S-a observat că noi marcaje epigenetice pot apărea ca urmare a schimbărilor de mediu și se pot perpetua timp de mai multe generații. Prezența unor efecte ereditare non-genetice, cu o influență directă asupra fenotipului, asigură un mecanism suplimentar de variabilitate care contribuie la înțelegerea originii biodiversității actuale.
Moștenirile (efectele) epigenetice sunt clar sesizabile atunci când parametrul analizat este dieta. Pe lângă faptul că influențează fenotipul unui individ, dieta poate influența fenotipul urmașilor. La mamiferele placentare, de exemplu, moștenirile materne cauzate de alimentație sunt de așteptat, deoarece mama și puii ei împart același sânge. Cu toate acestea, dezvoltarea embrionară a nevertebratelor este în mare măsură independentă de mamă și de mediul uterin după fertilizare. Prin urmare, prezența moștenirilor materne la descendenții nevertebratelor din cauza obiceiurilor alimentare ale mamei este deosebit de interesantă.[1] Moștenirile materne ale disponibilității nutrienților au fost deja observate la unele nevertebrate, cum ar fi Drosophila[2] și Caenorhabditis elegans.[3] În acest articol, o atenție specială va fi acordată studiilor privind efectele epigenetice materne care utilizează C. elegans ca model.
Nematodul C. elegans a fost izolat și descris inițial de către zoologul Émile Maupas la începutul anilor 1900. Datorită caracteristicilor sale morfologice și fiziologice unice, această specie a fost folosită ca organism model pentru mai multe domenii de cercetare fiind utilizată în studii fundamentale care au fost recompensate cu Premiul Nobel în 2002, 2006 și 2008.[4] Studiile care evaluează moștenirea epigenetică legată de alimentație la C. elegans s-au concentrat pe traseul insulinei și au arătat că aceasta afectează procese legate de dezvoltare, îmbătrânire, metabolism și rezistența la stres.[5] Modificările din acest traseu pot fi legate de moștenirile materne asupra plasticității fenotipice a descendenților de C. elegans. În acest context, Hibshman și colegii săi[6] au demonstrat că urmașii de C. elegans, supuși la restricție calorică, sunt protejați împotriva înfometării larvare, crescând mai rapid decât viermii care au primit cantități normale de hrană. De asemenea, ei au demonstrat că semnalizarea similară insulinei la nivel maternal reglează furnizarea de oocit în răspuns la disponibilitatea nutrienților. Reprogramarea epigenetică a traseului insulinei implică dezvoltarea unui „fenotip economic”, care este asociat cu o acumulare mai mare de grăsime ca rezultat al raționalizării nutrienților. În condiții normale, această acumulare de grăsime este dăunătoare organismului, dar poate fi extrem de benefică dacă descendenții trebuie să treacă prin aceleași situații stresante ca și părinții lor, oferindu-le astfel o mai bună pregătire.[7]
Este interesant faptul că, pentru C. elegans, există o rețea regulatoare comună care controlează nutriția descendenților în timpul dezvoltării embrionare, mărimea descendenților precum și longevitatea. Prin urmare, modificările aportului caloric au efecte pleiotropice asupra C. elegans, având ca rezultat modularea simultană a mai multor aspecte fiziologice și metabolice care pot duce la modificări ale dimensiunii, potențialului de reproducere și longevității pe parcursul a câteva generații. Potrivit lui Hibshman și colegilor lui,[8] funcția inter-generațională și potențial adaptivă a semnalizării similare insulinei găsită în C. elegans nu este limitată la acest nematod, ci poate fi verificată la multe alte organisme.
În plus față de regimul alimentar, s-a observat și o moștenire epigenetică legată de temperatură la C. elegans. Klosin și colegii săi,[9] de exemplu, au demonstrat că modificările în exprimarea genelor heterocromatice ale C. elegans, induse de o creștere a temperaturii, pot dura până la 14 generații. Astfel, putem afirma că variațiile în cadrul disponibilității hranei și a temperaturii pot genera o memorie epigenetică care se perpetuează timp de mai multe generații.[10]
Moștenirea epigenetică exemplificată de studiile asupra C. elegans arată că logica lamarckiană, care afirmă că un organism este capabil să se adapteze la mediu și să transmită aceste adaptări descendenților, poate să fie folosită, în limitele sale, pentru a explica procesele microevoluționare. Luând în considerare apariția mutațiilor în cadrul unor comunități de organisme și totodată prezența unor procese precum selecția naturală împreună cu deviația genetică, moștenirea epigenetică ar putea explica originea biodiversității vaste în doar câteva generații. Unele schimbări epigenetice pot duce chiar la apariția de mutații, ceea ce ar susține relevanța epigeneticii transgeneraționale pentru înțelegerea proceselor microevoluționare.[11] Caracterul mutagen al 5-metilcitozinelor, de exemplu, este de 10 ori mai mare decât cea a citozinelor nemetilate.[12]
Prin urmare, modificările mediului și disponibilitatea hranei pot genera efecte pleiotropice transcripționale și translaționale materne, transmise de la tulpinile strămoșești la cele moderne. Astfel, fiecare dintre aceste linii strămoșești ar fi putut fi izolată și să ocupe nișe diferite, ceea ce ar fi dus la apariția unei largi varietăți de fenotipuri distincte în doar câteva generații. Diferitele provocări cu care s-au confruntat aceste linii genetice ar fi putut duce la apariția unor populații cu strategii de supraviețuire extraordinare, așa cum s-a observat, de exemplu, la larvele dauer de C. elegans (Fig. 1).
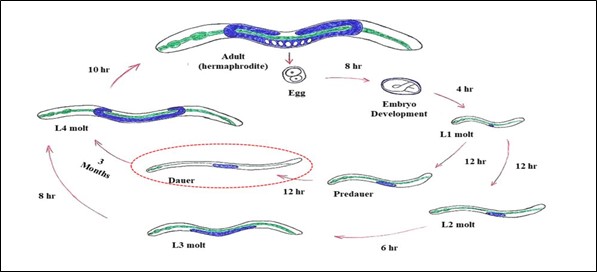
Figura 1. Ciclul de viață al organismului model C. elegans (3 până la 4 zile) la 20°C. Larva dauer este încercuită cu roșu. Sursa: https://pt.wikipedia.org/wiki/Caenorhabditis_elegans#/media/File:Ciclocelegans.jpg
În cadrul acestei strategii, larvele L1 de C. elegans care se confruntă cu situații stresante (de exemplu, densitate mare a populației, temperaturi ridicate și acces redus la hrană) intră într-un stadiu alternativ de dezvoltare cunoscut sub numele de larvă dauer. În acest stadiu, larva este capabilă să tolereze deshidratarea, intrând într-o stare de viețuire suspendată (ametabolică) cunoscută sub numele de anhidrobioză. În timpul suspendării vieții, C. elegans este capabil să reziste la condiții extreme de temperatură[13], radiații[14] și accelerație gravitațională[15] (Fig. 2). Alte nematode foarte asemănătoare cu C. elegans sunt holo-anhidrobioticele, ceea ce înseamnă că în toate stadiile acestor viermi, aceștia sunt capabili să intre într-o stare suspendată a vieții atunci când sunt deshidratați (figura 2). Printre acestea, putem menționa Panagrolaimus superbus, care aparține aceluiași ordin (Rhabditida) ca C. elegans având asemănări incredibile cu această specie. Recent, Souza și Pereira[16] au arătat că viermii P. superbus deshidratați pot rezista, de asemenea, la temperaturi extrem de scăzute (-196°C) și la doze mari de radiații (500 Gy de radiații X).
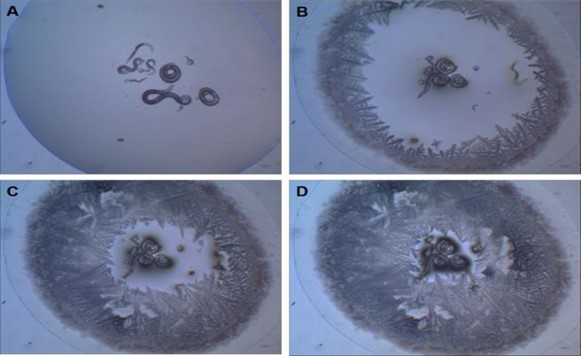
Figura 2: Deshidratarea progresivă (de la A la D) a nematodului P. superbus. Viermii au fost scufundați în soluție tampon M9 (22 mM KH2 PO4, 22 mM Na2 HPO4, 85 mM NaCl, 1 mM MgSO4) și au fost înconjurați de gel de silice pentru a permite deshidratarea. Fotografii proprii ale autorului.
Rezistența nematodelor la condiții stresante poate fi legată de modificările epigenetice din trecut de-a lungul mai multor generații. Putem presupune că liniile strămoșești supuse la condiții de stres succesive de-a lungul generațiilor au dus la o mare varietate de organisme cu genomuri și mecanisme distincte de rezistență la stres. Pentru a înțelege modul în care modificările epigenetice cauzate de situații stresante pot modela structura genomică a organismului, să luăm în considerare o altă specie de nematode apropiată de C. elegans, C. briggae. Multe asemănări între acești viermi indică o origine comună. C. briggae și C. elegans au același număr de cromozomi[17] și aproximativ același număr de gene codificatoare (19.500).[18] Este interesant faptul că modificările epigenetice pot provoca contracția sau expansiunea ADN-ului repetitiv. Reglarea metilării insulelor CpG, de exemplu, poate modifica numărul de regiuni repetitive, crescând rata de evoluție și conducând la schimbări morfologice după câteva generații. Având în vedere relația dintre modelul de metilare a genelor și condițiile de stres, rata de evoluție ar fi crescut în cazuri de foamete.[19]
Prin urmare, moștenirea epigenetică legată de condițiile stresante ar putea explica atât apariția strategiilor de rezistență, cât și creșterea modificărilor structurii genomice, care ar putea duce la schimbări morfologice drastice în câteva generații.[20] În acest context, ar trebui încurajate studiile privind modelele de moștenire epigenetică la C. elegans pentru a înțelege mai bine procesele microevolutive responsabile de biodiversitatea actuală.
Articol scris de Tiago Alves Jorge de Souza, PhD (Universitatea Adventistă din Sao Paulo) și publicat la data de 5 Decembrie 2018.
Articol preluat de la https://www.grisda.org/caenorhabditis-elegans-role-of-epigenetics-in-microevolution#_edn14
[1] Rando, O.J, Simmons, R. A. 2015. I’m Eating for Two: Parental Dietary Effects on Offspring Metabolism. Cell. Elsevier Inc.161: 93–105.
[2] Matzkin, L. M., Johnson, S., Paight, C., Markow, T. 2013. Preadult parental diet affects offspring development and metabolism in Drosophila melanogaster. PLoS One8: e59530.
[3] Frazier, H. N., Roth, M. B. 2009. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Current Biology 19: 859–63.
[4] de Souza T. A., Pereira, T. C. 2018. Caenorhabditis elegans Tolerates Hyperaccelerations up to 400,000 x g. Astrobiology 18(7):825-833.
[5] Murphy, C. T., Hu, P. J. 2013. Insulin/insulin-like growth factor signaling in C. elegans. WormBook. 1–43.
[6] Hibshman, J. D., Hung, A,, Baugh, L. R. 2016. Maternal Diet and Insulin-Like Signaling Control Intergenerational Plasticity of Progeny Size and Starvation Resistance. PLoS Genetics 12(10):e1006396.
[7] Hibshman, J. D., Hung, A,, Baugh, L. R. 2016. Maternal Diet and Insulin-Like Signaling Control Intergenerational Plasticity of Progeny Size and Starvation Resistance. PLoS Genetics 12(10):e1006396.
[8] Hibshman, J. D., Hung, A,, Baugh, L. R. 2016. Maternal Diet and Insulin-Like Signaling Control Intergenerational Plasticity of Progeny Size and Starvation Resistance. PLoS Genetics 12(10):e1006396.
[9] Klosin, A., Casas, E., Hidalgo-Carcedo, C., Vavouri, T., Lehner, B. 2017. Transgenerational transmission of environmental information in C. elegans. Science; 356(6335):320-323.
[10] Hibshman, J. D., Hung, A,, Baugh, L. R. 2016. Maternal Diet and Insulin-Like Signaling Control Intergenerational Plasticity of Progeny Size and Starvation Resistance. PLoS Genetics 12(10):e1006396; Klosin, A., Casas, E., Hidalgo-Carcedo, C., Vavouri, T., Lehner, B. 2017. Transgenerational transmission of environmental information in C. elegans. Science; 356(6335):320-323.
[11] You, J. S., Jones, P. A. 2012. Cancer genetics and epigenetics: two sides of the same coin? Cancer Cell 22(1):9-20.
[12] Rakyan, V., Whitelaw, E. 2003. Transgenerational epigenetic inheritance. Current Biology; 8;13(1):R6.
[13] Ujisawa, T., Ohta, A., Okahata, M., Sonoda, S., Kuhara, A. 2014.Cold tolerance assay for studying cultivation-temperature-dependent cold habituation in C. elegans. Protocol Exchange.
[14] Onodera, A., Yanase, S., Ishii, T., Yasuda, K., Miyazawa, M., Hartman, P. S., Ishii, N. 2010. Post-dauer life span of Caenorhabditis elegans dauer larvae can be modified by X-irradiation. Journal of Radiation Research 51 (1): 67-71.
[15] de Souza T. A., Pereira, T. C. 2018. Caenorhabditis elegans Tolerates Hyperaccelerations up to 400,000 x g. Astrobiology 18(7):825-833.
[16] Souza, T. A. J., Carli, G. J. and Pereira, T. C. 2017. Survival potential of the anhydrobiotic nematode Panagrolaimus superbus submitted to extreme abiotic stresses. Invertebrate Survival Journal 14: 85-93.
[17] Hibshman, J. D., Hung, A,, Baugh, L. R. 2016. Maternal Diet and Insulin-Like Signaling Control Intergenerational Plasticity of Progeny Size and Starvation Resistance. PLoS Genetics 12(10):e1006396.
[18] Stein, L. D., et al. 2003. The Genome Sequence of Caenorhabditis briggsae: A Platform for Comparative Genomics. PLoS Biol. 1(2): e45.
[19] Ruden, D. M.; Garfinkel, M. D., Xiao, L., Lu, X. 2005.Epigenetic Regulation of Trinucleotide Repeat Expansions and Contractions and the “Biased Embryos” Hypothesis for Rapid Morphological Evolution. Current Genomics 6:3.
[20] Ruden, D. M.; Garfinkel, M. D., Xiao, L., Lu, X. 2005.Epigenetic Regulation of Trinucleotide Repeat Expansions and Contractions and the “Biased Embryos” Hypothesis for Rapid Morphological Evolution. Current Genomics 6:3.


